GRACEVIT

当前页面所提供的药品信息仅适用于以上所选的国家。
适用于对本品敏感的金黄色葡萄球菌、凝固酶阴性葡萄球菌等葡萄球菌属;肺炎链球菌、化脓性链球菌、无乳链球菌等链球菌属;粪肠球菌、屎肠球菌等肠球菌属;卡他莫拉菌;大肠埃希菌;柠檬酸杆菌;肺炎克雷伯菌等克雷伯菌属;产气肠杆菌、阴沟肠杆菌等肠杆菌属;粘质沙雷菌等沙雷菌属;奇异变形杆菌等变形杆菌属;摩根摩根菌;流感嗜血杆菌;铜绿假单胞菌;消化链球菌等消化链球菌属;普雷沃菌;牙龈卟啉单胞菌等卟啉单胞菌属;梭杆菌属;沙眼衣原体;肺炎支原体;肺炎衣原体;嗜肺军团菌所引起的下列感染:
• 咽炎、喉炎、扁桃体炎(包括扁桃体周炎、扁桃体周脓肿)、急性支气管炎、感染性肺炎、慢性呼吸系统疾病的继发感染。
• 膀胱炎、肾盂肾炎、尿道炎。
• 宫颈炎。
• 中耳炎、鼻窦炎。
• 牙周炎、冠周炎、颌骨骨炎。
1日1次或2次口服本品500 mg后,经紫外光照射出现光毒性。
另外,1日2次静脉注射本品400 – 800 mg,出现剂量依赖性的QT间期延长,平均变化幅度在10 msec或以下。
以下患者禁用本品:
对本品的成分或其他喹诺酮类抗菌药有过敏史的患者。
妊娠期或可能妊娠的妇女(参考【孕妇及哺乳期妇女用药】)。
儿童(参考【儿童用药】)。
妊娠期或可能妊娠的妇女禁用本品(尚未确立妊娠期间用药的安全性)。
哺乳期妇女用药期间应停止哺乳(动物实验结果显示本品可经大鼠的乳汁分泌)。
【儿童用药】尚未确立本品对出生时低体重儿、新生儿、婴儿、幼儿和儿童的用药安全性。在动物实验中观察到幼犬关节软骨损伤;来自中国仓鼠的培养细胞,经过光照射后,发现可诱发染色体异常。故对上述人群禁用本品。
【老年用药】一般老年人的生理功能均有所降低,故应密切观察患者的状态,慎重给药(参考【药代动力学】)。
口服,成人1次50 mg(1片),1日2次;或1次100 mg(2片),1日1次;疗效不理想的患者可1次100 mg(2片),1日2次。
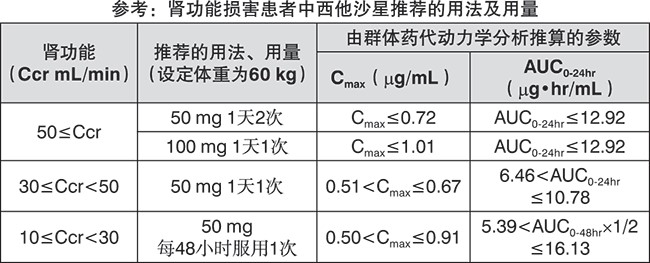
慎重给药(以下患者应慎重给药):肾功能损害患者[持续升高血药浓度(参考【药代动力学】);患有癫痫等惊厥性疾病或有相关既往史的患者(同类药物有诱发惊厥的报告);重症肌无力患者(同类药物有重症肌无力加重的报告);患有主动脉瘤或主动脉夹层并发症的患者,或有主动脉瘤或主动脉夹层既往病史、阳性家族史或危险因素(如马凡综合征)的患者[国外流行病学研究已有服用氟喹诺酮类药物后增加了主动脉瘤和主动脉夹层风险的报道(参考【不良反应】)];老年人(据报道肌腱病变更可能发生)(参考【老年用药】)。
重要注意事项:由于可能会发生主动脉瘤或主动脉夹层;因此应仔细观察患者,并告知患者在出现腹部、胸部或背部疼痛等症状时应及时就医。对于患有主动脉瘤或主动脉夹层并发症的患者,或有主动脉瘤或主动脉夹层既往病史、阳性家族史或危险因素的患者,必要时应考虑进行影像学评估。
用法用量相关的注意事项:
使用本品时为防止出现耐药菌等,原则上应确认细菌敏感性,将用药时间控制在疾病治疗所需的最短时间内。
肾功能损害患者用药后血药浓度会升高,故须调整给药剂量和给药间隔(参考【药代动力学】)。
治疗作用相关的使用注意事项:本品引发腹泻、松软便的发生率相对较高,故使用时须充分考虑风险获益的平衡(参考【不良反应】)。
在治疗咽炎、喉炎、扁桃体炎(包括扁桃体周炎、扁桃体周脓肿)、急性支气管炎、鼻窦炎时,需要参考相关的抗生素合理用药指南。在判断适合使用该药时,才使用该药。
其他注意事项:本品为PTP包装,请指导患者将药品从PTP板中取出后服用(有报道因误服PTP板后导致食管粘膜损伤,以及PTP板尖锐的边角引起穿孔,诱发纵隔炎等严重并发症)。
在日本的临床试验中,总病例1220例中有409例(33.5%)出现不良反应(包括实验室检查值异常)。主要的不良反应为:腹泻69例(5.7%)、松软便86例(7.0%)、头痛26例(2.1%)、ALT(GPT)升高72例(5.9%)、AST(GOT)升高59例(4.8%)、嗜酸粒细胞计数增多47例(3.9%)等。
在上市后临床试验中(时间:2008年12月 – 2010年11月,日本),总病例3331例中有148例(4.4%)出现不良反应(包括实验室检查值异常)。主要的不良反应为:腹泻41例(1.2%)、松软便14例(0.4%)、ALT(GPT)升高22例(0.7%)、AST(GOT)升高16例(0.5%)、皮疹12例(0.4%)等。
临床重大不良反应
休克、速发过敏反应*:可能会出现休克或速发过敏反应,因此应密切观察。如发现血压下降、呼吸困难、皮疹、血管性水肿等异常时,停止给药并采取适当的处理措施。
眼粘膜皮肤综合征(史蒂文斯-约翰逊综合征)*:可能发生眼粘膜皮肤综合征,故应密切观察,遇有异常应停止给药并采取适当的处理措施。
急性肾损伤*:曾有急性肾损伤的报道,故应密切观察,遇有异常应停止给药并采取适当的处理措施。
肝功能疾病(发生率<0.1%):曾有肝功能疾病[包括AST(GOT)升高、ALT(GPT)升高等]的报道,故应密切观察,遇有异常应停止给药并采取适当的处理措施。
血小板减少症*:曾有报道使用本品后出现血小板减少症,故应密切观察,遇有异常应停止给药并采取适当的处理措施。
假膜性结肠炎*:可能会发生假膜性结肠炎。如出现腹痛、频繁腹泻,应停止给药并采取适当的处理措施。
低血糖症(发生率<0.1%):有报道出现低血糖症,甚至出现低血糖昏迷,故应密切观察。遇有异常应停止给药并采取适当的处理措施。低血糖症多出现在糖尿病患者、肾功能损害和老年人群。
意识模糊、谵妄、幻觉等精神系统症状*:曾有报道使用本品后出现意识模糊、谵妄、幻觉等精神系统症状,故应密切观察,遇有异常应停止给药并采取适当的处理措施。
主动脉瘤、主动脉夹层*:可能会出现主动脉瘤或主动脉夹层。若观察到任何异常,应进行适当的治疗(参考【注意事项】)。
肌腱病变,如跟腱炎和肌腱断裂*:肌腱病变,如跟腱炎和肌腱断裂可能发生。如果观察到肌腱周围出现疼痛、肿胀和发红等症状,应该停止给药,并采取适当治疗措施。
*由于是来自自发报告的不良反应,因此发生率不明。
其他的喹诺酮类抗菌药临床重大不良反应
其他的喹诺酮类抗菌药曾报告过以下临床重大不良反应。故使用本品时亦应密切观察,出现以下异常应停止给药并采取适当的处理措施:中毒性表皮坏死松解症(TEN);惊厥;QT间期延长、室性心动过速(包括尖端扭转性室性心动过速);黄疸;间质性肺炎;横纹肌溶解;粒细胞缺乏症;全血细胞减少症;溶血性贫血;重症肌无力加重。
其他不良反应:可能会出现下述不良反应,当出现异常时应采取适当的处理措施,必要时停药。
超敏反应 ≥0.1%且<1%:皮疹,<0.1%:瘙痒、荨麻疹,发生率不明(由于是来自自发报告的不良反应,因此发生率不明,下同):光敏性。
精神神经系统 ≥0.1%且<1%:头晕、头痛,<0.1%:失眠。
胃肠系统 ≥1%且<5%:腹泻、松软便,≥0.1%且<1%:腹部不适、腹胀、腹痛、便秘、消化不良、恶心、口腔黏膜炎,<0.1%:唇炎、排便频率增加、舌炎、呕吐、口部感觉异常、口渴。
肝脏 ≥1%且<5%:ALT(GPT)升高、AST(GOT)升高,≥0.1%且<1%:LDH升高、γ-GTP升高、ALP升高。
血液 ≥1%且<5%:嗜酸粒细胞计数增多,≥0.1%且<1%:嗜中性粒细胞计数降低、血小板数计数增多、白细胞计数降低,<0.1%:白细胞计数增多。
其他 ≥0.1%且<1%:CK(CPK)升高、血糖降低、血钾升高、甘油三酯升高、尿蛋白阳性,<0.1%:阴道念珠菌病、背痛、寒战、感觉异常、乏力感、血钾降低,发生率不明:水肿。
本品与下列药物合并用药时应注意:
• 含有铝或镁的抗酸剂、含钙制剂、含铁制剂
临床症状、处理方法:合并用药可能会减弱本品的疗效。这些药物应在服用本品2小时之后再使用。
机制、风险因子:本品可与这些药物形成螯合物,从而影响本品在胃肠道的吸收,导致药物全身浓度比预期值低。
• 苯乙酸或丙酸类非甾体消炎镇痛药(酮洛芬等)
临床症状:有引发惊厥的可能。
机制、风险因子:本品与这些药物同时服用时,可能通过抑制本品与中枢神经系统中GABAa受体的结合,增加中枢神经系统刺激的风险。
• 皮质类固醇:泼尼松龙、氢化可的松等(口服和注射)
临床症状、处理方法:据报道,肌腱病变的风险增加。只有当治疗的益处大于风险时,才可以使用本品联合皮质类固醇治疗。
机制、风险因子:发生机制不详。
25℃以下密闭保存。
有效期36个月。
西他沙星的化学名称:(–)-7-[(7S)-7-氨基-5-氮杂螺[2.4]-5-庚基]-8-氯-6-氟-1-[(1R,2S)-2-氟环丙基]-1,4-二氢-4-氧代-喹啉-3-羧酸倍半水合物。分子式:C19H18ClF2N3O3·1½H2O,分子量:436.84。
性状:本品为白色至微黄色薄膜衣片,除去包衣后显微黄色至淡黄色。
西他沙星为喹诺酮类抗菌药,通过抑制细菌DNA旋转酶和拓扑异构酶IV的活性发挥杀菌作用。西他沙星对需氧和厌氧的革兰阳性菌和革兰阴性菌、非典型病原体都有广谱抗菌作用,对葡萄球菌属、链球菌属、肺炎链球菌、肠球菌属、卡他莫拉菌、大肠埃希菌、柠檬酸杆菌属、克雷伯菌属、肠杆菌属、沙雷菌属、变形杆菌属、摩氏摩根菌、流感嗜血杆菌、铜绿假单胞菌、嗜肺军团菌、消化链球菌属、普雷沃尔菌属、卟啉菌属、梭形杆菌属、沙眼衣原体、肺炎衣原体、肺炎支原体等有抗菌作用。
在以呼吸系统感染患者为受试者的临床试验中进行了PK/PD分析,结果显示病原菌的清除率随着AUC0-24hr/MIC或Cmax/MIC的升高而增加。AUC0-24hr/MIC超过100时有22株肺炎链球菌在内的呼吸系统感染的主要病原菌的清除率达96.3%(78/81),Cmax/MIC超过5时达96.3%(79/82)。此外,以肺炎球菌性呼吸道感染患者为受试者的临床试验结果显示,以西他沙星非结合形式的血药浓度计算,AUC0-24hr/MIC>30时以及Cmax/MIC>2时病原菌清除率均达到98.9%(89/90)。
【临床试验】各类疾病的有效率:在以呼吸道感染、尿路感染、耳鼻喉感染、牙齿感染、口腔手术区域感染及生殖器官感染患者为研究对象的临床试验中,给予患者西他沙星50 mg一日2次或100 mg一日1次或2次,各疾病的有效率如下文[疾病名称:有效例数/评价例数(有效率)]:
所有疾病:991/1059(93.6%)。
呼吸道感染:总体:493/528(93.4%)。
– 咽炎、喉炎:8/8(100%)。
– 扁桃体炎(包括扁桃体周炎,扁桃体周脓肿):11/12(91.7%)。
– 急性支气管炎:14/14(100%)。
– 肺炎 总体:350/373(93.8%);细菌性肺炎:323/344(93.9%);非典型肺炎(包括细菌混合感染) 总体:27/29(93.1%),支原体肺炎:20/22(90.9%),衣原体肺炎:6/6(100%),军团菌肺炎:1/1。
– 慢性呼吸道疾病的继发感染:106/117(90.6%)。
尿路感染总体:302/318(95.0%)。
膀胱炎:239/252(94.8%)。
肾盂肾炎:63/66(95.5%)。
非淋菌性性传播疾病 总体:70/75(93.3%)。
– 尿道炎 总体:31/35(88.6%),非淋菌性衣原体性:23/27(85.2%),非淋菌性非衣原体性:8/8(100%)。
– 宫颈炎:39/40(97.5%)。
耳鼻咽喉感染 总体:85/96(88.5%)。
– 中耳炎:43/49(87.8%)。
– 鼻窦炎:42/47(89.4%)。
牙齿感染、口腔手术感染 总体:41/42(97.6%)。
– 牙周炎:17/17(100%)。
– 冠周炎:7/7(100%)。
– 颌骨骨炎:17/18(94.4%)。
对病原微生物的清除率:以呼吸道感染、尿路感染、耳鼻喉感染、牙齿感染、口腔手术区域感染及生殖器官感染患者为研究对象,根据临床试验收集的病原微生物的清除率见下文[菌种、菌属:清除菌株数/评价菌株数(菌株清除率)]:
葡萄球菌属 108/113(95.6%)。
链球菌属(除肺炎链球菌)61/61(100%)。
肺炎链球菌 157/164(95.7%)。
青霉素耐药肺炎链球菌a 13/14(92.9%)。
青霉素中度耐药肺炎链球菌b 50/52(96.2%)。
大环内酯类耐药肺炎链球菌c 110/116(94.8%)。
多重耐药性肺炎链球菌d 81/85(95.3%)。
肠球菌属 111/112(99.1%)。
卡他莫拉(布拉汉)菌 35/35(100%)。
大肠埃希菌 123/133(92.5%)。
柠檬酸杆菌属 12/12(100%)。
克雷伯菌属 54/58(93.1%)。
肠杆菌属 14/14(100%)。
沙雷菌属 7/9(77.8%)。
变形杆菌属 7/8(87.5%)。
摩根摩根菌 4/4。
流感嗜血杆菌 108/108(100%)。
BLNARe 31/31(100%)。
铜绿假单胞菌 33/47(70.2%)。
来源于呼吸系统感染的铜绿假单胞菌 2/11(18.2%)。
来源于尿路系统感染的铜绿假单胞菌 30/33(90.9%)。
消化链球菌属 21/21(100%)。
普雷沃菌属 33/33(100%)。
卟啉单胞菌属 3/3。
梭杆菌属 2/2。
沙眼衣原体 63/65(96.9%)。
肺炎衣原体 1/1。
肺炎支原体 13/13(100%)。
a 青霉素G:MIC≥2 μg/mL[采用口服青霉素V的标准(CLSI法)];
b 青霉素G:0.12 μg/mL≤MIC≤1 μg/mL[采用口服青霉素V的标准(VLSI法)];
c 克拉霉素:MIC≥1 μg/mL或红霉素:MIC≥1 μg/mL;
d 2种或2种以上药物耐药:耐喹诺酮类药物(左氧氟沙星:MIC≥8 μg/mL或者莫西沙星:MIC≥4 μg/mL)、耐青霉素(青霉素G:MIC≥2 μg/mL[采用口服青霉素的标准(CLSI法)]、耐头孢(头孢呋辛:MIC≥2 μg/mL)、耐大环内酯类(克拉霉素:MIC≥1 μg/mL或红霉素:MIC≥1 μg/mL)、耐泰利霉素(泰利霉素:MIC≥4 μg/mL)、耐四环素(四环素:MIC≥8 μg/mL)、耐甲氧苄氨嘧啶-磺胺甲基异噁唑(甲氧苄氨嘧啶-磺胺甲基异噁唑:MIC≥76/4 μg/mL);
e β-内酰胺酶阴性耐氨苄西林的流感嗜血杆菌。
【药代动力学】血清药物浓度:健康成人在空腹及餐后单次口服西他沙星,血清中浓度的变化及药代动力学参数如下所示。
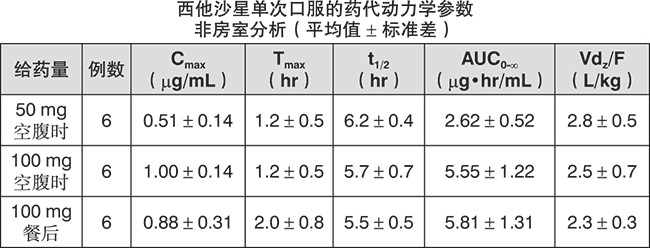
血清蛋白结合率:健康成人单次口服西他沙星100 mg,服药1、4、8小时后,本品与血清蛋白的结合率为46% – 55%(超滤法),各时间点结合率基本恒定。
分布:单次口服西他沙星50或100 mg 后,各组织及体液中浓度的变化如下所示,显示良好的组织/体液分布。
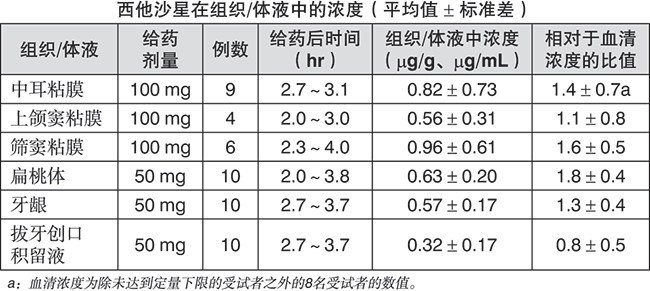
代谢:西他沙星在体内大部分直接以原型药物从尿中排出,并已确认在血清、尿、粪便中可检出少量代谢物,如葡萄糖苷酸、7’-氧代物、7’S-氢氧化物、7’S-氢氧化物的葡糖苷酸、N-乙酰结合物。
采用生物样本进行的体外试验中,西他沙星对细胞色素P450中的CYP1A1和CYP1A2有较弱的抑制作用,但不会抑制CYP2C9、CYP2D6和CYP3A4等。
排泄:健康成人单次空腹口服西他沙星50或100 mg,给药后48小时内约70%的给药量以原型药物从尿中排出。
另外,研究显示口服14C标记的西他沙星100 mg后,72小时内约80%的给药量从尿中、约20%的给药量从粪便中排出。
肾功能损害患者的药代动力学:根据肌酐清除率(Ccr)数值将受试者分为3组,单次空腹口服西他沙星50 mg,结果显示随着肾功能的降低,血清中药物浓度的消除和尿排泄均延长。
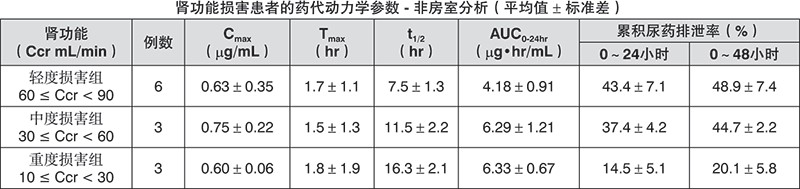
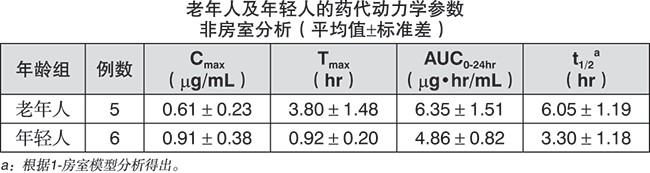
老年人的药代动力学:5名老年人(67 – 80岁)及6名年轻人(25 – 35岁)单次空腹口服西他沙星100 mg。与年轻人比较,老年人的t1/2延长、Cmax下降及AUC0-24hr增加。结果表明随年龄增加、吸收排泄功能的下降会影响西他沙星的药代动力学。
重复给药毒性:大鼠连续4周和连续13周经口给药的毒性试验中,尿中药物结晶(未伴发肾脏病变)和自发的骨及软骨病变加重。大鼠连续4周经口给药的毒性试验中雌雄动物的无毒性反应剂量均为46.9 mg/kg/日,13周试验中均为20 mg/kg/日。
食蟹猴连续4周和连续52周经口给药的毒性试验中,睾丸生精小管中精细胞数量减少,血清磷脂有轻度增加。食蟹猴连续4周经口给药的毒性试验中雌雄动物的无毒性反应剂量均为28.1 mg/kg/日,52周试验中均为25 mg/kg/日。
遗传毒性:西他沙星Ames试验、体外染色体畸变试验及小鼠淋巴瘤TK试验结果均为阳性,体内微核试验、程序外DNA合成试验及显性致死试验均为阴性。
生殖毒性:西他沙星对大鼠亲代动物未见生殖毒性,但家兔试验中出现了一般抗菌药物常见的流产动物数增加的现象。西他沙星对胚胎和胎仔有轻度影响,但对大鼠和家兔未见致畸作用。
关节毒性:西他沙星在幼犬中引起关节软骨空洞、糜烂,但在成年犬中未见关节毒性。
光毒性:小鼠光毒性试验中,白化小鼠及有色小鼠的无毒性反应剂量分别为20 mg/kg及93.8 mg/kg。
光遗传毒性:光照下的体外染色体畸变试验结果为阳性,但光照下的体内小鼠试验中,20 mg/kg剂量下试验结果为阴性。
8g 喹诺酮类 Quinolones
薄膜衣片 50 mg x 6片,10片,12片。
第一三共(中国) Daiichi-Sankyo (China)
适用于对本品敏感的金黄色葡萄球菌、凝固酶阴性葡萄球菌等葡萄球菌属;肺炎链球菌、化脓性链球菌、无乳链球菌等链球菌属;粪肠球菌、屎肠球菌等肠球菌属;卡他莫拉菌;大肠埃希菌;柠檬酸杆菌;肺炎克雷伯菌等克雷伯菌属;产气肠杆菌、阴沟肠杆菌等肠杆菌属;粘质沙雷菌等沙雷菌属;奇异变形杆菌等变形杆菌属;摩根摩根菌;流感嗜血杆菌;铜绿假单胞菌;消化链球菌等消化链球菌属;普雷沃菌;牙龈卟啉单胞菌等卟啉单胞菌属;梭杆菌属;沙眼衣原体;肺炎支原体;肺炎衣原体;嗜肺军团菌所引起的下列感染:
• 咽炎、喉炎、扁桃体炎(包括扁桃体周炎、扁桃体周脓肿)、急性支气管炎、感染性肺炎、慢性呼吸系统疾病的继发感染。
• 膀胱炎、肾盂肾炎、尿道炎。
• 宫颈炎。
• 中耳炎、鼻窦炎。
• 牙周炎、冠周炎、颌骨骨炎。
Copyright MIMS
1日1次或2次口服本品500 mg后,经紫外光照射出现光毒性。
另外,1日2次静脉注射本品400 – 800 mg,出现剂量依赖性的QT间期延长,平均变化幅度在10 msec或以下。
Copyright MIMS
以下患者禁用本品:
对本品的成分或其他喹诺酮类抗菌药有过敏史的患者。
妊娠期或可能妊娠的妇女(参考【孕妇及哺乳期妇女用药】)。
儿童(参考【儿童用药】)。
Copyright MIMS
妊娠期或可能妊娠的妇女禁用本品(尚未确立妊娠期间用药的安全性)。
哺乳期妇女用药期间应停止哺乳(动物实验结果显示本品可经大鼠的乳汁分泌)。
【儿童用药】尚未确立本品对出生时低体重儿、新生儿、婴儿、幼儿和儿童的用药安全性。在动物实验中观察到幼犬关节软骨损伤;来自中国仓鼠的培养细胞,经过光照射后,发现可诱发染色体异常。故对上述人群禁用本品。
【老年用药】一般老年人的生理功能均有所降低,故应密切观察患者的状态,慎重给药(参考【药代动力学】)。
Copyright MIMS
口服,成人1次50 mg(1片),1日2次;或1次100 mg(2片),1日1次;疗效不理想的患者可1次100 mg(2片),1日2次。
Copyright MIMS
慎重给药(以下患者应慎重给药):肾功能损害患者[持续升高血药浓度(参考【药代动力学】);患有癫痫等惊厥性疾病或有相关既往史的患者(同类药物有诱发惊厥的报告);重症肌无力患者(同类药物有重症肌无力加重的报告);患有主动脉瘤或主动脉夹层并发症的患者,或有主动脉瘤或主动脉夹层既往病史、阳性家族史或危险因素(如马凡综合征)的患者[国外流行病学研究已有服用氟喹诺酮类药物后增加了主动脉瘤和主动脉夹层风险的报道(参考【不良反应】)];老年人(据报道肌腱病变更可能发生)(参考【老年用药】)。
重要注意事项:由于可能会发生主动脉瘤或主动脉夹层;因此应仔细观察患者,并告知患者在出现腹部、胸部或背部疼痛等症状时应及时就医。对于患有主动脉瘤或主动脉夹层并发症的患者,或有主动脉瘤或主动脉夹层既往病史、阳性家族史或危险因素的患者,必要时应考虑进行影像学评估。
用法用量相关的注意事项:
使用本品时为防止出现耐药菌等,原则上应确认细菌敏感性,将用药时间控制在疾病治疗所需的最短时间内。
肾功能损害患者用药后血药浓度会升高,故须调整给药剂量和给药间隔(参考【药代动力学】)。
治疗作用相关的使用注意事项:本品引发腹泻、松软便的发生率相对较高,故使用时须充分考虑风险获益的平衡(参考【不良反应】)。
在治疗咽炎、喉炎、扁桃体炎(包括扁桃体周炎、扁桃体周脓肿)、急性支气管炎、鼻窦炎时,需要参考相关的抗生素合理用药指南。在判断适合使用该药时,才使用该药。
其他注意事项:本品为PTP包装,请指导患者将药品从PTP板中取出后服用(有报道因误服PTP板后导致食管粘膜损伤,以及PTP板尖锐的边角引起穿孔,诱发纵隔炎等严重并发症)。
Copyright MIMS
在日本的临床试验中,总病例1220例中有409例(33.5%)出现不良反应(包括实验室检查值异常)。主要的不良反应为:腹泻69例(5.7%)、松软便86例(7.0%)、头痛26例(2.1%)、ALT(GPT)升高72例(5.9%)、AST(GOT)升高59例(4.8%)、嗜酸粒细胞计数增多47例(3.9%)等。
在上市后临床试验中(时间:2008年12月 – 2010年11月,日本),总病例3331例中有148例(4.4%)出现不良反应(包括实验室检查值异常)。主要的不良反应为:腹泻41例(1.2%)、松软便14例(0.4%)、ALT(GPT)升高22例(0.7%)、AST(GOT)升高16例(0.5%)、皮疹12例(0.4%)等。
临床重大不良反应
休克、速发过敏反应*:可能会出现休克或速发过敏反应,因此应密切观察。如发现血压下降、呼吸困难、皮疹、血管性水肿等异常时,停止给药并采取适当的处理措施。
眼粘膜皮肤综合征(史蒂文斯-约翰逊综合征)*:可能发生眼粘膜皮肤综合征,故应密切观察,遇有异常应停止给药并采取适当的处理措施。
急性肾损伤*:曾有急性肾损伤的报道,故应密切观察,遇有异常应停止给药并采取适当的处理措施。
肝功能疾病(发生率<0.1%):曾有肝功能疾病[包括AST(GOT)升高、ALT(GPT)升高等]的报道,故应密切观察,遇有异常应停止给药并采取适当的处理措施。
血小板减少症*:曾有报道使用本品后出现血小板减少症,故应密切观察,遇有异常应停止给药并采取适当的处理措施。
假膜性结肠炎*:可能会发生假膜性结肠炎。如出现腹痛、频繁腹泻,应停止给药并采取适当的处理措施。
低血糖症(发生率<0.1%):有报道出现低血糖症,甚至出现低血糖昏迷,故应密切观察。遇有异常应停止给药并采取适当的处理措施。低血糖症多出现在糖尿病患者、肾功能损害和老年人群。
意识模糊、谵妄、幻觉等精神系统症状*:曾有报道使用本品后出现意识模糊、谵妄、幻觉等精神系统症状,故应密切观察,遇有异常应停止给药并采取适当的处理措施。
主动脉瘤、主动脉夹层*:可能会出现主动脉瘤或主动脉夹层。若观察到任何异常,应进行适当的治疗(参考【注意事项】)。
肌腱病变,如跟腱炎和肌腱断裂*:肌腱病变,如跟腱炎和肌腱断裂可能发生。如果观察到肌腱周围出现疼痛、肿胀和发红等症状,应该停止给药,并采取适当治疗措施。
*由于是来自自发报告的不良反应,因此发生率不明。
其他的喹诺酮类抗菌药临床重大不良反应
其他的喹诺酮类抗菌药曾报告过以下临床重大不良反应。故使用本品时亦应密切观察,出现以下异常应停止给药并采取适当的处理措施:中毒性表皮坏死松解症(TEN);惊厥;QT间期延长、室性心动过速(包括尖端扭转性室性心动过速);黄疸;间质性肺炎;横纹肌溶解;粒细胞缺乏症;全血细胞减少症;溶血性贫血;重症肌无力加重。
其他不良反应:可能会出现下述不良反应,当出现异常时应采取适当的处理措施,必要时停药。
超敏反应 ≥0.1%且<1%:皮疹,<0.1%:瘙痒、荨麻疹,发生率不明(由于是来自自发报告的不良反应,因此发生率不明,下同):光敏性。
精神神经系统 ≥0.1%且<1%:头晕、头痛,<0.1%:失眠。
胃肠系统 ≥1%且<5%:腹泻、松软便,≥0.1%且<1%:腹部不适、腹胀、腹痛、便秘、消化不良、恶心、口腔黏膜炎,<0.1%:唇炎、排便频率增加、舌炎、呕吐、口部感觉异常、口渴。
肝脏 ≥1%且<5%:ALT(GPT)升高、AST(GOT)升高,≥0.1%且<1%:LDH升高、γ-GTP升高、ALP升高。
血液 ≥1%且<5%:嗜酸粒细胞计数增多,≥0.1%且<1%:嗜中性粒细胞计数降低、血小板数计数增多、白细胞计数降低,<0.1%:白细胞计数增多。
其他 ≥0.1%且<1%:CK(CPK)升高、血糖降低、血钾升高、甘油三酯升高、尿蛋白阳性,<0.1%:阴道念珠菌病、背痛、寒战、感觉异常、乏力感、血钾降低,发生率不明:水肿。
Copyright MIMS
本品与下列药物合并用药时应注意:
• 含有铝或镁的抗酸剂、含钙制剂、含铁制剂
临床症状、处理方法:合并用药可能会减弱本品的疗效。这些药物应在服用本品2小时之后再使用。
机制、风险因子:本品可与这些药物形成螯合物,从而影响本品在胃肠道的吸收,导致药物全身浓度比预期值低。
• 苯乙酸或丙酸类非甾体消炎镇痛药(酮洛芬等)
临床症状:有引发惊厥的可能。
机制、风险因子:本品与这些药物同时服用时,可能通过抑制本品与中枢神经系统中GABAa受体的结合,增加中枢神经系统刺激的风险。
• 皮质类固醇:泼尼松龙、氢化可的松等(口服和注射)
临床症状、处理方法:据报道,肌腱病变的风险增加。只有当治疗的益处大于风险时,才可以使用本品联合皮质类固醇治疗。
机制、风险因子:发生机制不详。
Copyright MIMS
25℃以下密闭保存。
有效期36个月。
Copyright MIMS
西他沙星的化学名称:(–)-7-[(7S)-7-氨基-5-氮杂螺[2.4]-5-庚基]-8-氯-6-氟-1-[(1R,2S)-2-氟环丙基]-1,4-二氢-4-氧代-喹啉-3-羧酸倍半水合物。分子式:C19H18ClF2N3O3·1½H2O,分子量:436.84。
性状:本品为白色至微黄色薄膜衣片,除去包衣后显微黄色至淡黄色。
Copyright MIMS
西他沙星为喹诺酮类抗菌药,通过抑制细菌DNA旋转酶和拓扑异构酶IV的活性发挥杀菌作用。西他沙星对需氧和厌氧的革兰阳性菌和革兰阴性菌、非典型病原体都有广谱抗菌作用,对葡萄球菌属、链球菌属、肺炎链球菌、肠球菌属、卡他莫拉菌、大肠埃希菌、柠檬酸杆菌属、克雷伯菌属、肠杆菌属、沙雷菌属、变形杆菌属、摩氏摩根菌、流感嗜血杆菌、铜绿假单胞菌、嗜肺军团菌、消化链球菌属、普雷沃尔菌属、卟啉菌属、梭形杆菌属、沙眼衣原体、肺炎衣原体、肺炎支原体等有抗菌作用。
在以呼吸系统感染患者为受试者的临床试验中进行了PK/PD分析,结果显示病原菌的清除率随着AUC0-24hr/MIC或Cmax/MIC的升高而增加。AUC0-24hr/MIC超过100时有22株肺炎链球菌在内的呼吸系统感染的主要病原菌的清除率达96.3%(78/81),Cmax/MIC超过5时达96.3%(79/82)。此外,以肺炎球菌性呼吸道感染患者为受试者的临床试验结果显示,以西他沙星非结合形式的血药浓度计算,AUC0-24hr/MIC>30时以及Cmax/MIC>2时病原菌清除率均达到98.9%(89/90)。
【临床试验】各类疾病的有效率:在以呼吸道感染、尿路感染、耳鼻喉感染、牙齿感染、口腔手术区域感染及生殖器官感染患者为研究对象的临床试验中,给予患者西他沙星50 mg一日2次或100 mg一日1次或2次,各疾病的有效率如下文[疾病名称:有效例数/评价例数(有效率)]:
所有疾病:991/1059(93.6%)。
呼吸道感染:总体:493/528(93.4%)。
– 咽炎、喉炎:8/8(100%)。
– 扁桃体炎(包括扁桃体周炎,扁桃体周脓肿):11/12(91.7%)。
– 急性支气管炎:14/14(100%)。
– 肺炎 总体:350/373(93.8%);细菌性肺炎:323/344(93.9%);非典型肺炎(包括细菌混合感染) 总体:27/29(93.1%),支原体肺炎:20/22(90.9%),衣原体肺炎:6/6(100%),军团菌肺炎:1/1。
– 慢性呼吸道疾病的继发感染:106/117(90.6%)。
尿路感染总体:302/318(95.0%)。
膀胱炎:239/252(94.8%)。
肾盂肾炎:63/66(95.5%)。
非淋菌性性传播疾病 总体:70/75(93.3%)。
– 尿道炎 总体:31/35(88.6%),非淋菌性衣原体性:23/27(85.2%),非淋菌性非衣原体性:8/8(100%)。
– 宫颈炎:39/40(97.5%)。
耳鼻咽喉感染 总体:85/96(88.5%)。
– 中耳炎:43/49(87.8%)。
– 鼻窦炎:42/47(89.4%)。
牙齿感染、口腔手术感染 总体:41/42(97.6%)。
– 牙周炎:17/17(100%)。
– 冠周炎:7/7(100%)。
– 颌骨骨炎:17/18(94.4%)。
对病原微生物的清除率:以呼吸道感染、尿路感染、耳鼻喉感染、牙齿感染、口腔手术区域感染及生殖器官感染患者为研究对象,根据临床试验收集的病原微生物的清除率见下文[菌种、菌属:清除菌株数/评价菌株数(菌株清除率)]:
葡萄球菌属 108/113(95.6%)。
链球菌属(除肺炎链球菌)61/61(100%)。
肺炎链球菌 157/164(95.7%)。
青霉素耐药肺炎链球菌a 13/14(92.9%)。
青霉素中度耐药肺炎链球菌b 50/52(96.2%)。
大环内酯类耐药肺炎链球菌c 110/116(94.8%)。
多重耐药性肺炎链球菌d 81/85(95.3%)。
肠球菌属 111/112(99.1%)。
卡他莫拉(布拉汉)菌 35/35(100%)。
大肠埃希菌 123/133(92.5%)。
柠檬酸杆菌属 12/12(100%)。
克雷伯菌属 54/58(93.1%)。
肠杆菌属 14/14(100%)。
沙雷菌属 7/9(77.8%)。
变形杆菌属 7/8(87.5%)。
摩根摩根菌 4/4。
流感嗜血杆菌 108/108(100%)。
BLNARe 31/31(100%)。
铜绿假单胞菌 33/47(70.2%)。
来源于呼吸系统感染的铜绿假单胞菌 2/11(18.2%)。
来源于尿路系统感染的铜绿假单胞菌 30/33(90.9%)。
消化链球菌属 21/21(100%)。
普雷沃菌属 33/33(100%)。
卟啉单胞菌属 3/3。
梭杆菌属 2/2。
沙眼衣原体 63/65(96.9%)。
肺炎衣原体 1/1。
肺炎支原体 13/13(100%)。
a 青霉素G:MIC≥2 μg/mL[采用口服青霉素V的标准(CLSI法)];
b 青霉素G:0.12 μg/mL≤MIC≤1 μg/mL[采用口服青霉素V的标准(VLSI法)];
c 克拉霉素:MIC≥1 μg/mL或红霉素:MIC≥1 μg/mL;
d 2种或2种以上药物耐药:耐喹诺酮类药物(左氧氟沙星:MIC≥8 μg/mL或者莫西沙星:MIC≥4 μg/mL)、耐青霉素(青霉素G:MIC≥2 μg/mL[采用口服青霉素的标准(CLSI法)]、耐头孢(头孢呋辛:MIC≥2 μg/mL)、耐大环内酯类(克拉霉素:MIC≥1 μg/mL或红霉素:MIC≥1 μg/mL)、耐泰利霉素(泰利霉素:MIC≥4 μg/mL)、耐四环素(四环素:MIC≥8 μg/mL)、耐甲氧苄氨嘧啶-磺胺甲基异噁唑(甲氧苄氨嘧啶-磺胺甲基异噁唑:MIC≥76/4 μg/mL);
e β-内酰胺酶阴性耐氨苄西林的流感嗜血杆菌。
【药代动力学】血清药物浓度:健康成人在空腹及餐后单次口服西他沙星,血清中浓度的变化及药代动力学参数如下所示。

血清蛋白结合率:健康成人单次口服西他沙星100 mg,服药1、4、8小时后,本品与血清蛋白的结合率为46% – 55%(超滤法),各时间点结合率基本恒定。
分布:单次口服西他沙星50或100 mg 后,各组织及体液中浓度的变化如下所示,显示良好的组织/体液分布。

代谢:西他沙星在体内大部分直接以原型药物从尿中排出,并已确认在血清、尿、粪便中可检出少量代谢物,如葡萄糖苷酸、7’-氧代物、7’S-氢氧化物、7’S-氢氧化物的葡糖苷酸、N-乙酰结合物。
采用生物样本进行的体外试验中,西他沙星对细胞色素P450中的CYP1A1和CYP1A2有较弱的抑制作用,但不会抑制CYP2C9、CYP2D6和CYP3A4等。
排泄:健康成人单次空腹口服西他沙星50或100 mg,给药后48小时内约70%的给药量以原型药物从尿中排出。
另外,研究显示口服14C标记的西他沙星100 mg后,72小时内约80%的给药量从尿中、约20%的给药量从粪便中排出。
肾功能损害患者的药代动力学:根据肌酐清除率(Ccr)数值将受试者分为3组,单次空腹口服西他沙星50 mg,结果显示随着肾功能的降低,血清中药物浓度的消除和尿排泄均延长。


老年人的药代动力学:5名老年人(67 – 80岁)及6名年轻人(25 – 35岁)单次空腹口服西他沙星100 mg。与年轻人比较,老年人的t1/2延长、Cmax下降及AUC0-24hr增加。结果表明随年龄增加、吸收排泄功能的下降会影响西他沙星的药代动力学。

Copyright MIMS
重复给药毒性:大鼠连续4周和连续13周经口给药的毒性试验中,尿中药物结晶(未伴发肾脏病变)和自发的骨及软骨病变加重。大鼠连续4周经口给药的毒性试验中雌雄动物的无毒性反应剂量均为46.9 mg/kg/日,13周试验中均为20 mg/kg/日。
食蟹猴连续4周和连续52周经口给药的毒性试验中,睾丸生精小管中精细胞数量减少,血清磷脂有轻度增加。食蟹猴连续4周经口给药的毒性试验中雌雄动物的无毒性反应剂量均为28.1 mg/kg/日,52周试验中均为25 mg/kg/日。
遗传毒性:西他沙星Ames试验、体外染色体畸变试验及小鼠淋巴瘤TK试验结果均为阳性,体内微核试验、程序外DNA合成试验及显性致死试验均为阴性。
生殖毒性:西他沙星对大鼠亲代动物未见生殖毒性,但家兔试验中出现了一般抗菌药物常见的流产动物数增加的现象。西他沙星对胚胎和胎仔有轻度影响,但对大鼠和家兔未见致畸作用。
关节毒性:西他沙星在幼犬中引起关节软骨空洞、糜烂,但在成年犬中未见关节毒性。
光毒性:小鼠光毒性试验中,白化小鼠及有色小鼠的无毒性反应剂量分别为20 mg/kg及93.8 mg/kg。
光遗传毒性:光照下的体外染色体畸变试验结果为阳性,但光照下的体内小鼠试验中,20 mg/kg剂量下试验结果为阴性。
Copyright MIMS
8g 喹诺酮类 Quinolones
Copyright MIMS
薄膜衣片 50 mg x 6片,10片,12片。
Copyright MIMS
第一三共(中国) Daiichi-Sankyo (China)
Copyright MIMS





